Strukturelle Bioinformatik
Stanisław Dunin-Horkawicz
Wir entwickeln und nutzen bioinformatische Anwendungen, um die Funktion von proteinbasierten Systemen aus einer evolutionären Perspektive zu untersuchen. Mit diesem Ansatz können wir gegenwärtige Systeme im Kontext der evolutionären Ereignisse beschreiben, die sie geformt haben, ihre einzigartigen und konservierten Merkmale definieren und überprüfbare Hypothesen aufstellen.
Protein-Evolution
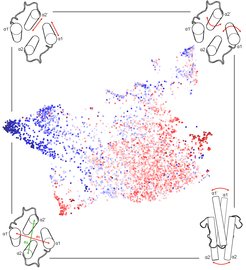
Der Nachweis von Homologie, also der der Abstammung von einem gemeinsamen Vorfahren, durch Sequenzvergleich ist typischerweise der erste Schritt bei der Untersuchung von Proteinfunktion und -evolution. Wir haben pLM-BLAST entwickelt, ein Werkzeug zur Identifizierung homologer Regionen zwischen Proteinsequenzen. pLM-BLAST verwendet Protein-Sprachmodelle, tiefe neuronale Netzwerke, die mit großen Mengen von Proteinsequenzdaten trainiert wurden, um genaue Vorhersagen schnell zu treffen. Diese Methode wird aktiv entwickelt und der Wissenschaftsgemeindeüber das MPI Bioinformatics Toolkit (https://toolkit.tuebingen.mpg.de/tools/plmblast) zur Verfügung gestellt. In unserer Gruppe verwenden wir pLM-BLAST neben anderen Ansätzen zur Untersuchung der Evolution proteinbasierter Systeme. Besonders sind wir daran interessiert, die Evolution und die Abstammung von Proteinfaltungen von Systemen der angeborenen Immunität und der Apoptose zu entschlüsseln.
Coiled-coil-Strukturen
Coiled-Coil-Domänen in Proteinen bestehen aus zwei oder mehr Alpha-Helices, die in regelmäßigen Bündeln gewunden sind. Durch diese Regelmäßigkeit können Coiled-Coil-Strukturen durch parametrische Gleichungen beschrieben werden, was eine genaue Quantifizierung und den In-silico-Entwurf neuer Strukturen mit bestimmten Parametern ermöglicht. Diese Eigenschaften machen Coiled Coils zu einem idealen Modell für die Untersuchung der Beziehung zwischen Proteinsequenz, Struktur und Funktion. In unserer Gruppe entwickeln wir Werkzeuge zur Erkennenung, Klassifizierung und Beschreibung von Coiled Coils in Strukturen und Sequenzen. Wir interessieren uns für Coiled-Coil-Domänen in prokaryotischen Signaltransduktionsrezeptoren, wie z. B. der HAMP-Domäne, die extrazelluläre Sensoren mit intrazellulären Effektoren verbinden. Wir wollen verstehen, wie die Dynamik dieser Domänen zu ihrer Funktion beiträgt.
